圖:taste-2研究2026年1月7日發(fā)表于BMJ雜志
卒中是我國(guó)成年人致死����、致殘的首位病因,其中約70%為缺血性卒中(AIS)���。目前�,急性缺血性卒中治療已進(jìn)入“再灌注時(shí)代”���,血管內(nèi)取栓是救治大血管閉塞患者的“金標(biāo)準(zhǔn)”�。盡管取栓術(shù)能實(shí)現(xiàn)高達(dá)70%-90%的血管再通�����,但仍有近一半的患者留下不同程度的殘疾�。如何進(jìn)一步保護(hù)缺血腦組織、降低卒中致殘��,仍是全球面臨的臨床難題�。
國(guó)際權(quán)威學(xué)術(shù)組織STAIR曾提出,缺血性卒中治療中理想的腦細(xì)胞保護(hù)策略應(yīng)能多靶點(diǎn)干預(yù)缺血損傷�,并與再灌注治療聯(lián)合。由中國(guó)自主研發(fā)的多靶點(diǎn)腦細(xì)胞保護(hù)劑依達(dá)拉奉右莰醇率先在該領(lǐng)域獲得成功的臨床驗(yàn)證�����。
該大規(guī)模隨機(jī)雙盲對(duì)照試驗(yàn)在中國(guó)106家中心開展���,共納入1362名患者�����。所有患者均在發(fā)病24小時(shí)內(nèi)接受取栓治療��,并隨機(jī)分組���,在取栓前開始接受依達(dá)拉奉右莰醇或安慰劑治療���,持續(xù)約兩周。
研究主要目標(biāo)是評(píng)估患者90天后的功能獨(dú)立(改良Rankin量表評(píng)分0-2分�,即恢復(fù)完全生活自理能力)的情況。最終數(shù)據(jù)顯示���,相較于安慰劑組���,依達(dá)拉奉右莰醇顯著改善了患者90天功能獨(dú)立結(jié)局,且兩組在嚴(yán)重不良事件�、死亡率等安全性指標(biāo)上無(wú)顯著差別。
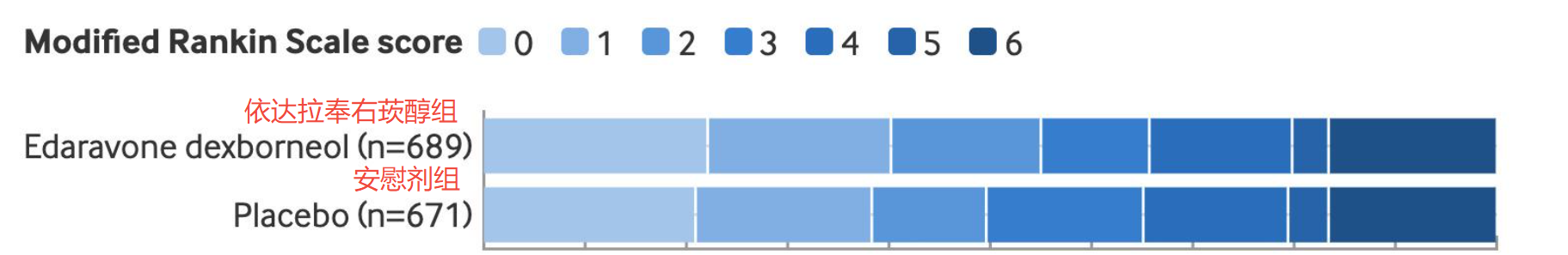
圖:TASTE-2結(jié)果顯示�,患者治療后恢復(fù)功能獨(dú)立 (90天mRS 0~2分)比例上,依達(dá)拉奉右莰醇組(55.0%)與安慰劑組(49.6%)相比有顯著提高(P=0.047)
值得注意的是�,亞組分析顯示,入院時(shí)影像學(xué)與臨床癥狀不匹配的患者可從治療中獲得更明顯的獲益 (55.5% vs 42.9%)�。這提示,依達(dá)拉奉右莰醇在血管內(nèi)治療前使用�����,可能通過(guò)減輕缺血再灌注損傷和繼發(fā)性炎癥而發(fā)揮“凍結(jié)半暗帶”的作用。急性缺血性卒中治療有望從單純依賴“時(shí)間窗”向更精準(zhǔn)的“組織窗”評(píng)估的重要轉(zhuǎn)變��。對(duì)于存在明顯“不匹配”的患者����,積極采取聯(lián)合治療(腦細(xì)胞保護(hù)劑+再灌注治療)可能帶來(lái)顯著獲益�����。
“TASTE-2研究的結(jié)果非常令人鼓舞���?�!毖芯康谝蛔髡?,北京天壇醫(yī)院王春娟教授表示:“它首次在嚴(yán)格設(shè)計(jì)的大樣本臨床試驗(yàn)中證實(shí)�����,在取栓這一強(qiáng)大血流重建基礎(chǔ)上�����,加用多靶點(diǎn)腦保護(hù)藥物能夠進(jìn)一步為患者帶來(lái)功能獲益���。這不僅僅是藥物的成功��,更代表了一種治療理念的落地——即‘血管再通’與‘腦細(xì)胞保護(hù)’協(xié)同并重的綜合治療模式���,這可能成為未來(lái)卒中治療的新標(biāo)準(zhǔn)�����?!?/span>
先必新®(依達(dá)拉奉右莰醇注射用濃溶液)是先聲藥業(yè)自主研發(fā)的多靶點(diǎn)腦細(xì)胞保護(hù)劑���,國(guó)家1類新藥����。該藥物含依達(dá)拉奉和右莰醇兩種活性成分�,可高效透過(guò)血腦屏障,通過(guò)抗炎和清除自由基雙效協(xié)同��,減少腦缺血引發(fā)的級(jí)聯(lián)損傷���。作為全球卒中治療領(lǐng)域自2015年來(lái)唯一獲批上市銷售的創(chuàng)新藥���,該藥物歷時(shí)12年研發(fā)��,并兩次獲得國(guó)家“重大新藥創(chuàng)制”專項(xiàng)支持�����。
北京天壇醫(yī)院王擁軍教授團(tuán)隊(duì)主導(dǎo)的TASTE研究�,以及北京大學(xué)第三醫(yī)院樊東升教授牽頭的TASTE-SL研究���,分別證實(shí)了依達(dá)拉奉右莰醇注射劑型�����,以及舌下片劑型對(duì)非取栓AIS患者的療效。相關(guān)數(shù)據(jù)于2021年和2024年發(fā)表在國(guó)際神經(jīng)病學(xué)頂級(jí)期刊STROKE(《卒中》)和JAMA Neurology(《美國(guó)醫(yī)學(xué)會(huì)神經(jīng)病學(xué)雜志 》)���,為醫(yī)學(xué)界重啟了卒中腦細(xì)胞保護(hù)研究的大門����。依達(dá)拉奉右莰醇舌下片也獲美國(guó)食品藥品監(jiān)督管理局(FDA)突破性療法認(rèn)定�����,是全球卒中治療領(lǐng)域首個(gè)被FDA認(rèn)定為突破性療法的創(chuàng)新藥��。
TASTE-2研究,證實(shí)了AIS患者在取栓前使用依達(dá)拉奉右莰醇可進(jìn)一步獲益�,以新的臨床證據(jù)不斷拓展著科學(xué)對(duì)“腦細(xì)胞保護(hù)”的認(rèn)知。BMJ雜志的高級(jí)別臨床證據(jù)發(fā)表��,有望推動(dòng)腦細(xì)胞保護(hù)相關(guān)藥物作為取栓等血管內(nèi)治療的聯(lián)合用藥��,為進(jìn)一步提升卒中治療效果���,減少卒中致殘��。